NEWS
お知らせ
NEWS
- 教育・学生生活
- 教員養成センター
- 入試
- 一般競争契約情報
- 入札
- お知らせ
- イベント
- プレスリリース
- 本学の新型コロナウイルス感染状況
- 受験生の方へ
- 在学生の方へ
- 卒業生の方へ
- 企業の方へ
- 地域・一般 の方へ
- 学務支援システム
- eポートフォリオ
- 調整会のお知らせ
- 地域未来共創センター(愛称:Tottori uniQ)
- 保健管理センター
- 教養教育センター
- 鳥取大学学友会
- 鳥取大学好友会
- 鳥取大学は今
- 附属学校部
【研究成果】免疫応答を制御する分子の新たな機能を示唆する立体構造を解明
概要
鳥取大学工学部付属グリーン・サスティナブル・ケミストリー研究センターの佐藤裕介講師、李彦君 (博士課程)、京都大学理学研究科の深井周也教授、尾勝圭助教らの研究グループは、免疫応答の制御に関わるタンパク質「TAB2」が、細胞内機能を制御する因子である「K6結合型ユビキチン鎖」と結合した状態の立体構造決定に成功しました。
細胞内にたくさん存在するユビキチン(※1)というタンパク質は、いくつもつながる事でユビキチン鎖を形成し、さまざまな役割を果たします。ユビキチン鎖を形成する際のユビキチン同士のつながり方は8種類あって、ユビキチンのどの部分を使ってつながるのかによってユビキチン鎖の機能は異なります(※2)。これまでに、K63でつながったユビキチン鎖とTAB2というタンパク質が結合することで細胞内にシグナルが伝わり、NF-κBという転写因子が核内へと移動することで、免疫応答に関わる遺伝子が活性化することがわかっていました(※3)。一方、最近の研究によって、TAB2がK63だけなくK6でつながったユビキチン鎖とも結合するという事が発見されました。しかし、K6でつながったユビキチン鎖の細胞内での機能はいまだ良くわかっていない点が多く、また、TAB2とK6でつながったユビキチン鎖との結合様式も不明でした。
今回、佐藤裕介講師らは、TAB2とK6でつながったユビキチン鎖が結合した状態の立体構造を決定することで、TAB2がどのようにK6でつながったユビキチン鎖を認識して結合しているかを明らかにしました。本研究は、免疫応答制御機構を解明する今後の研究に役立つ知見になると期待されます。
今回の成果は2021年8月17日に米国の科学雑誌『Biophysical Journal』に掲載されました。研究背景
酵母からヒトまで、真核生物の細胞内には76個のアミノ酸がつながってできた小さなタンパク質であるユビキチンが、細胞内の様々な機能を制御しています(図1)。このユビキチンは他のタンパク質に結合することで働きます。この際、単独のユビキチンとしても働きますが、ユビキチンがいくつもつながってできるユビキチン鎖も、さまざまな細胞機能を制御するための標識として働きます。ユビキチン鎖は、ユビキチンのC末端のグリシンと、他のユビキチンのN末端メチオニン(M1)、もしくは7つあるリジン残基(K6、K11、K27、K29、K33、K48、K63)が共有結合することで形成されます(図1)。このとき、ユビキチンのどの残基を使ってユビキチン鎖が形成されるのかによって、その機能と構造が異なることがわかっています。たとえば、外部からの感染のシグナルが伝わると、細胞内にK63でつながったユビキチン鎖が合成されます。TAB2というタンパク質はK63でつながったユビキチン鎖を特異的に認識することで、さらに細胞内へとシグナルを伝達させ、最終的に免疫応答制御に関与する遺伝子を活性化させます。TAB2がK63でつながったユビキチン鎖とどのように結合するのかは私達の研究グループの解析によって既に解明されていましたが、最近になってTAB2はK6でつながったユビキチン鎖とも結合することが発見されました。しかし、K6でつながったユビキチン鎖の機能はまだ未解明な部分が多く、K6でつながったユビキチン鎖が免疫応答制御に関与するという報告はないため、TAB2とK6でつながったユビキチン鎖が結合することの意義はわかっていません。また、TAB2がどのようにK6でつながったユビキチン鎖を認識するのかも明らかにされていませんでした。
研究内容・成果
佐藤裕介講師らは、TAB2とK6でつながったユビキチン鎖とが結合した状態の結晶を作製し、その立体構造を決定しました(図2)。今回作製したユビキチン鎖はユビキチンを2つつなげたものですが、C末端G76で他のユビキチンと結合している方を遠位のユビキチン、結合されている方を近位のユビキチンと呼びます。TAB2はK6でつながったユビキチン鎖の遠位と近位の2つのユビキチンと同時に結合していました。さらに、私達の研究グループによって既に解明されていたTAB2がK63でつながったユビキチン鎖と結合している状態の構造と比較すると、遠位のユビキチンC末端領域を除き、おどろくほど2つの構造は似ている事がわかりました。この結果から、TAB2がユビキチン鎖と強く結合するためには、ユビキチン鎖の隣り合う2つのユビキチンがTAB2の決まった位置に同時に結合する必要がある、ということがわかりました。また、K6でつながったユビキチン鎖と、K63でつながったユビキチン鎖が、同じ構造を取る事ができる理由は、遠位のユビキチンのC末端領域が非常に柔軟であるためであるという事もわかりました。特定のユビキチン鎖のみと結合する分子は、1種類のユビキチン鎖のみと結合する事がほとんどですが、TAB2はK6、K63という2種類のつながり方のユビキチン鎖とも結合する珍しい機能を持ちます。本研究で解明した立体構造から、遠位のユビキチンの柔軟なC末端の構造が、2種類のユビキチン鎖との結合に重要な役割を持つという事が明らかになりました。
今後の展望
ユビキチン鎖は様々な種類があり、それぞれが異なる機能を有することがわかっていますが、K6でつながったユビキチン鎖の役割などは未解明な点が多く残されています。本研究の成果により、免疫応答制御に関与するTAB2がK6でつながったユビキチン鎖とどのように結合しているのかというメカニズムが明らかにされました。今後、K6でつながったユビキチン鎖は細胞内でどのような機能を有しているのか?免疫応答制御に関与しているのかどうか?関与しているとしたら、どのように関与しているのか?といった疑問の解明に役立つと期待されます。
参考図
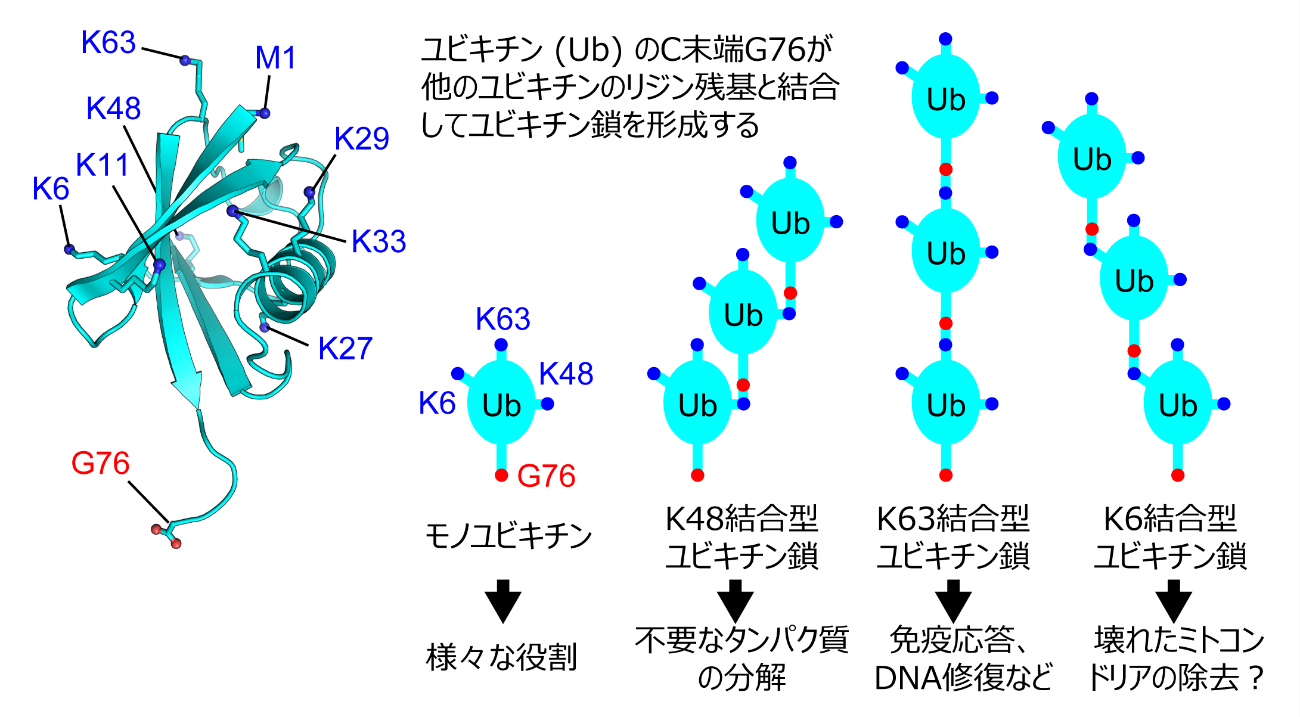
図1 ユビキチン鎖のモデル。ユビキチンのリジン(K)やN末端のメチオニン(M1)に、次のユビキチンのC末端グリシン(G76)が結合することでユビキチン鎖が作られる。ユビキチン同士がどのアミノ酸を用いてつながるかによって、ユビキチン鎖の機能と構造は大きく異なる。この図では、8種類のユビキチン鎖のうちK48、K63、K6でつながったユビキチン鎖を例に挙げて説明した。
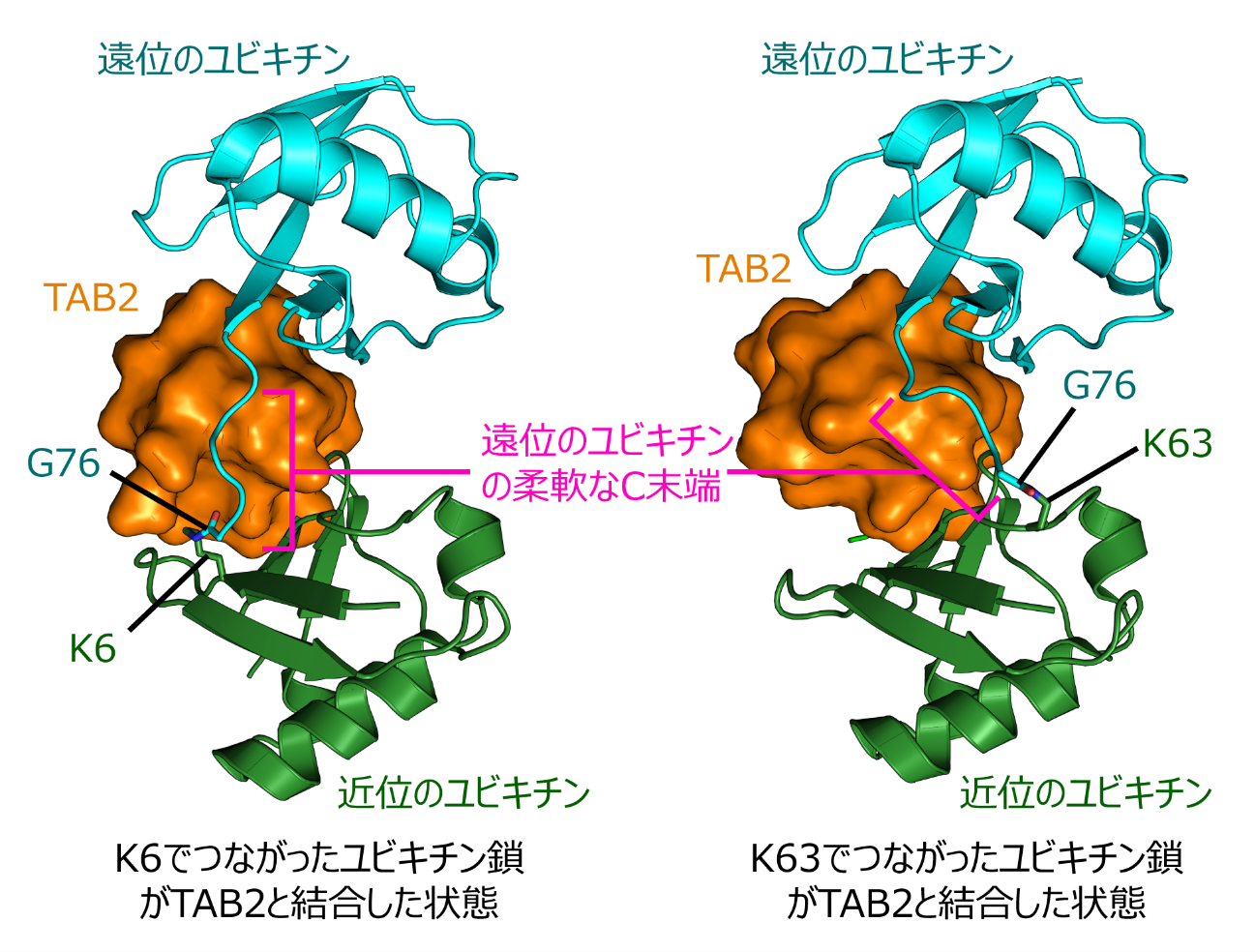
図2 TAB2とK6でつながったユビキチン鎖とが結合した状態の構造(左)。私達の研究グループによってすでに構造解析されていた、TAB2とK63でつながったユビキチン鎖とが結合した状態の構造も比較のため示した(右)。2つの構造は、遠位のユビキチンのC末端領域のみが異なることがわかる。
原論文情報
論文タイトル:Structural basis for specific recognition of K6-linked polyubiquitin chains by the TAB2 NZF domain
著者:Li Yanjun, Kei Okatsu, Shuya Fukai, and Yusuke Sato
DOI番号:10.1016/j.bpj.2021.06.037
用語解説
※1 ユビキチン
76個のアミノ酸からなる小さなタンパク質で、C末端のグリシンが標的のタンパク質のリジン残基と結合することで、様々な生体反応の目印となる。
※2 ユビキチン鎖
複数のユビキチンがつながった状態。ユビキチンに存在するN末端メチオニン(M1)、もしくは7つあるリジン残基(K6、K11、K27、K29、K33、K48、K63)に他のユビキチンがつながっていくことで形成される。どのリジン残基を使ってユビキチン鎖を形成するかによって、8種類のユビキチン鎖が存在し、そのつながり方によって機能と構造が大きく異なる。
※3 NF-κB(エヌエフ・カッパー・ビー)
さまざまな遺伝子の転写を活性化するタンパク質。細胞がストレスやサイトカインなどの刺激を受けると、細胞質の様々なタンパク質にユビキチン鎖やリン酸が付加されることでシグナルが伝達される。この結果、NF-κBは核内へと移動して免疫応答などに関する様々な遺伝子の転写を活性化する。


